Modern periyodik Sistem
Periyot: Periyodik sistemdeki 7 yatay satıra denir. Aynı periyotta bulunan elementlerin elektron bulunduran katman sayısı eşittir.
Grup: Periyodik sistemdeki düşey sütunlara denir. 8 tane A(baş) grubu, 10 tane de B(yan) grubu bulunur, toplam 18 grup bulunur. A gruplarında bir elementin kaç tane değerlik elektronu varsa o element o gruba aittir. IUPAC sistemine göre bu 18 grup 1 ile 18 arasında numaralandırılmıştır. Aynı grupta bulunan elementlerin fiziksel ve kimyasal nitelikleri benzerdir. A gruplarının özel isimleri vardır:
-1A Alkali metaller
H, Li, Na K içerisindeki önemli elementlerdir. Hidrojen Alkali Metaller grubundadır, fakat Alkali Metal değildir. Bu elementler bazik karakter gösterir ve metalik olarak en aktif grup da budur.
Not: Cu, Hg, Ag, Pt, Au hariç tüm metaller asitlerle birleşince hidrojen gazı ortaya çıkarır.
-2A Toprak alkali metaller
Be, Mg, Ca içerir. Bileşiklerde 2 bağ yapar.
Not: Li, Rb, K, Ba, Sr, Ca, Na en aktif metallerdir. Soğuk suyla bile etkileşime girerler.
Aktif Metal + Su ➩ Baz(suda) + H2(suda)
-3A Toprak metalleri
Bor ve Aliminyum
-4A Karbon grubu
C, Si, Pl, Sn
-5A Azot grubu
N, P
-6A Kalkojenler
O, S
Not: Elektron arttıkça polarlanabilirlik artar.
-7A Halojenler
F, Cl, Br, I. Bileşikte 1 bağ yaparlar. Tabiatta diatomik bulunur.
-8A Soygazlar
Helyum, Ne, Ar. Özel durumlar dışında bileşmez.
Katman Elektron Dizilimi kuralları
Elektronlar çekirdek çevresinde belirli enerji düzeylerinde bulunur. enerji içten dışa doğru artar. Katmanlar sayılar veya harflerle gösterilirler.
-Her katmanda belirli sayıda elektron bulunur. Bir katmanda en fazla 2n2 elektron bulunabilir.
-Bir katman dolmadan sıradakai katmana geçilmez.
-Bir atomun en dış katmanına en fazla 8 elektron bulunabilir.
Değerlik Elektron
Temel haldeki bir element atomunun katman-elektron diziliminde en son katmanındaki elektron sayısıdır.
Örnek: Sodyum 11 ---> )2 )8)1 ---> değerlik elektron sayısı 1'dir.
Uyarılmış Hal Elektron Dizilimi
Temel haldeki bir atom yeterli enerji aldığında en son katmanındaki elektronlar bir sonraki enerji düzeyine geçer.
Uyarılmış Sodyum 11 --> )2 )8 )0 )1
Periyodik Sistemde yer bulma
Oksijen 8 ---> )2 )6
Katman sayısı=Periyot numarası=2
Değerlik e- sayısı=Grup numarası=6
Elementlerin Sınıflandırılması
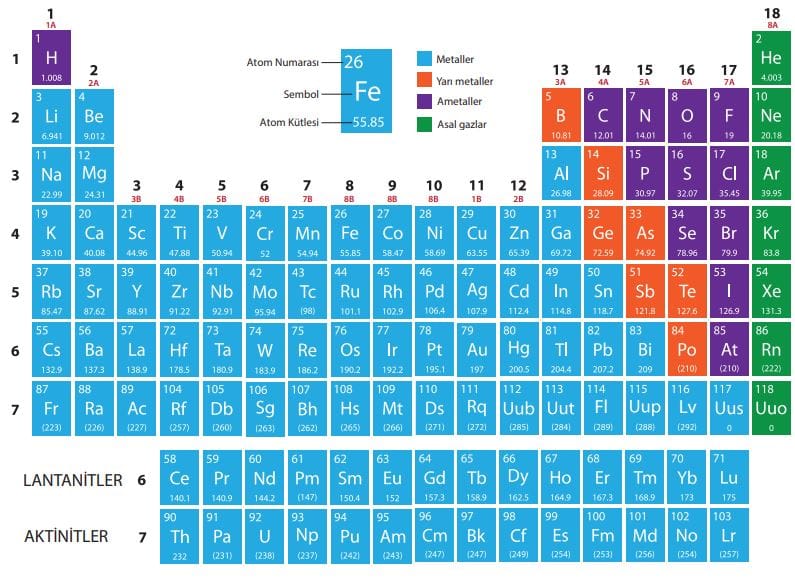
Metaller
Yeni kesilmiş yüzeyleri parlaktır. Isıyı ve elektriği iletirler. Tel ve lehva haline getirilebilirler. Ametallerle iyonik bağ kurup bileşebilirler, diğer metallerle metalik bağla alaşım oluşturabilirler, fakat bileşik kurmazlar. Bileşiklerde katyon olurlar. Erime ve kaynama noktaları yüksektir. Çoğu serttir. Cıva dışında hepsi oda sıcaklığında katıdır. Serbest halde atomik yapılılardır. Bazıları bileşikte değişken değer alabilir.
Ametaller
Serbest halde moleküllü yapıya sahiptir. Kendi aralarında kovalent bağ oluştururlar. Metallerle iyonik bileşik oluştururlar, anyon olurlar. Yüzeyleri mattır. Isı ve elektrik iletmezler (grafit hariç). Tel ve levha olmazlar. Erime ve kaynama noktaları düşüktür.
Yarı Metaller
Parlak yada mattır. Fiziksel olarak metale, kimyasal olarak ametale benzerler. Bu sebeple ametallerle bileşik oluşturabilirler. Çoğu tel ve levha olabilir. İletkenlikleri metallerden az, ametallerden çoktur. Sıcaklık arttıkça iletkenlikleri artar. Oda koşullarında katılardır. Kendi aralarında ve ametallerle bileşebilirler, hem anyon hem katyon olabilirler.
Soygazlar
Oda koşullarında gaz haldedirler. Kaynama noktaları düşüktür. Bileşik yapmaya yatkın değillerdir. Serbest halde atomiklerdir.
Atom Yarıçapı
Bir atomun yarıçapı kabaca çekirdekten en dış katmana kadardır. Tabloda gruplarda katman sayısı arttıkça çap artar. Kardan adam taktiği kullanılarak tablo üzerinde artış gözlenebilir.
İyonlaşma Enerjisi
Gaz halindeki bir nötr atom yada iyondan bir elektron koparmak için gereken enerji. Çok elektronlu atomların birden çok İE'si vardır. Bir atomun teorik olarak elektron sayısı kadar İE'si vardır. Bir atomdan her elektron koparılıdığında İE artar. Bir atomun tüm değerlik elektronları koparıldığında İE değerinde anormal boyutlarda artış gözlenir. Bunun üzerinden atomların değerlik elektron sayısı bulunabilir. İE ayırt edici özelliktir. 1. İE A gruplarında tablonun genellikle sağ üst köşesine yaklaştıkça artar.
Elektron İlgisi
Gaz halindeki nötr bir atomun bir elektron alması sırasındaki enerji değişimidir. Genellikle ekzotermiktir. Tablonun sağ üst köşesine yaklaştıkça artar.
Elektronegatiflik
Bir molekülde bağ yapan iki atomun bağ elektronlarını kendisine doğru çekme kuvvetidir. Metallerde düşük, ametallerde yüksektir. Atomlar arası EN farkı arttıkça bağın iyonik karakteri artar, kovalent karakteri azalır. EN'nin en çok olduğu element Flor'dur. Tablonun sağ üst köşesine yaklaştıkça artar.
Metalik-Ametalik Özellik
Metal aktifliği elektron verme üzerinedir, tablonun sol alt köşesine yaklaştıkça artar. Ametallerin aktifliği elektron alma üzerinedir, tablonun sağ üst köşesine yaklaştıkça artar.
Oksitlerin Asitliği-Bazlığı
Metallerin oksitleri baziktir. Oksitlerin bazlığı tablonun sol alt köşesine yaklaştıkça artar. Ametallerin oksitleri asidiktir. Oksitlerin asitliği tablonun sağ üst köşesine yaklaştıkça artar.